phương pháp nhiệt luyện: cần sử dụng chất khử (CO, H2; C; Al) nhằm khử ion kim loại trong những oxit
Chọn đáp án B.
Bạn đang xem: Có thể điều chế cu bằng cách dùng h2
Câu hỏi trên ở trong đề trắc nghiệm tiếp sau đây !
Số câu hỏi: 1198
tự CuS hoàn toàn có thể điều chế Cu bằng cách nào sau đây ?
A.
hài hòa CuS bằng dung dịch HCl, tiếp đến dùng sắt đẩy đồng khỏi dung dịch
B.
hài hòa CuS bằng dung dịch HCl, sau đó cô cạn dung dịch, mang khan mang điện phân lạnh chảy
C.
Đốt cháy CuS thành CuO cùng , sau đó khử CuO bởi CO (to)
D.
hòa tan CuS bằng dung dịch HCl, rồi điện phân dung dịch CuCl2
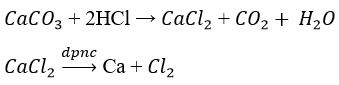
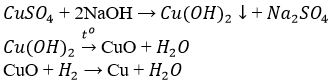
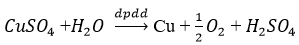
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Để khử hoàn toàn 30 gam hỗn hợp tất cả CuO, FeO, Fe3O4, Fe2O3,Fe, MgO đề nghị dùng 5,6 lít khí co (đktc). Cân nặng chất rắn nhận được sau phản bội ứng là :
A. 28g.
B. 26g.
C. 24g.
D. 22g.
Một loại quặng sắt chứa 80% Fe2O3và 10% SiO2. Hàm lượng các nguyên tử Fe và Si trong quặng này là :
A. 56% Fe với 4,7% Si
B. 54% Fe cùng 3,7% Si
C. 53% Fe và 2,7% Si
D. 52% Fe và 4,7% Si
tự Cu(OH)2, MgO, Fe2O3hãy điều chế những kim loại tương ứng bằng phương pháp thích hợp. Viết phương trình chất hóa học của phản nghịch ứng.
Điện phân (điện rất trơ) hỗn hợp muối sunfua của một sắt kẽm kim loại hóa trị II với chiếc điện cường độ 3A. Sau khoản thời gian 1930 giây năng lượng điện phân thấy trọng lượng catot tăng 1,92 gam.Xác định thương hiệu kim loại.
Điện phân (điện cực trơ) hỗn hợp muối sunfua của một kim loại hóa trị II với loại điện độ mạnh 3A. Sau khoản thời gian 1930 giây năng lượng điện phân thấy trọng lượng catot tăng 1,92 gam.
Viết phương trình hóa học của phản ứng xẩy ra tại từng điện rất và phương trình chất hóa học chung của việc điện phân.
Trang chủ
Sách ID
khóa học miễn phí
Luyện thi ĐGNL cùng ĐH 2023
Điều chế Cu từ CuSO4
Câu hỏi: Điều chế Cu từ bỏ CuSO4
Từ CuSO4điều chế Cu hoàn toàn có thể dùng phương pháp : năng lượng điện phân dung dịch , thủy luyện, nhiệt độ luyện.
- Thủy luyện : tự CuSO4+ sắt → FeSO4+ Cu
- sức nóng luyện :
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Cu(OH)2 →to CuO + H2O
CuO + H2 → Cu + H2O
- Điện phân dung dịch :
Cùng vị trí cao nhất lời giải đi kiếm hiểu về đặc thù hóa học tập của Cu và hợp chất nhé.
A. ĐỒNG
I. địa điểm trong bảng tuần hoàn- cấu trúc nguyên tử
Cấu hình e nguyên tử:29Cu: 1s22s22p63s23p63d104s1⇔⌊Ar⌋ 3d104s1Vị trí: ô 29, chu kỳ 4, đội IB.Cấu hình e của các ion:Cu+: 1s22s22p63s23p63d10
Cu2+: 1s22s22p63s23p63d9
II. đặc điểm vật lý
Đồng gồm mạng tinh thể lập phương tâm diện, màu đỏ, dẻo, dễ dàng kéo sợi, dát mỏng. Dẫn điện với nhiệt xuất sắc chỉ kém bạc, tonc= 10830C, D = 8,98 g/cm3.
III. đặc điểm hóa học tập của đồng
Đồng tất cả tính khử yếu:
Cu → Cu2++ 2e
1. Công dụng với phi kim
– khi (Cu) bội phản ứng với Oxi đun nóng sẽ tạo nên thành CuO đảm bảo do kia (Cu) sẽ không xẩy ra oxi hoá.
2Cu + O2→ CuO
– khi ta nấu nóng đến ánh sáng từ (800-1000oC)
CuO + Cu → Cu2O (đỏ)
– Khi chức năng trực tiếp cùng với khí Cl2, Br2, S…
Cu + Cl2→ CuCl2
Cu + S→ CuS
2. Chức năng với axit
– (Cu) không thể tính năng với hỗn hợp HCl và H2SO4 loãng.
Xem thêm: Tại Sao Nói Nghề Dạy Học Là Nghề Dùng Nhân Cách Để Giáo Dục Nhân Cách
– Khi bao gồm oxi, (Cu) có thể công dụng với hỗn hợp HCl, tất cả tiếp xúc thân axit và không khí.
2 Cu + 4HCl + O2 → 2 CuCl2 + 2 H2O
– Đối cùng với HNO3, H2SO4 quánh thì:
Cu + 2 H2SO4 đ→ CuSO4 + SO2 + H2O
Cu + 4HNO3(đặc)→ Cu(NO3)2 + 2NO2 + 2H2O
3. Công dụng với dung dịch muối
Cu + 2AgNO3→ Cu(NO3)2+ 2Ag
Cu + 2Fe3+→ Cu2++ 2Fe2+
Chú ý với muối nitrat trong môi trường thiên nhiên axit:3Cu + 8H++ 2NO3-→ 3Cu2++2NO + 4H2O
B- HỢP CHẤT CỦA ĐỒNG
I. Hợp hóa học đồng (I)
1. Cu2O
- Là chất rắn màu đỏ gạch, ko tan vào nước.
-Tính chất hoá học:
+) tác dụng với axit:
Cu2O + 2HCl→ CuCl2+ H2O + Cu
+) dễ dẫn đến khử:
Cu2O + H2→ 2Cu + H2O
2. Cu(OH)
-Là hóa học kết tủa color vàng.
-Tính chất hoá học: dễ dẫn đến phân hủy:
2CuOH → Cu2O + H2O
II. Hợp chất đồng (II)
1. Đồng(II) oxit(CuO)
- Là chất rắn màu sắc đen, không tan vào nước.
- Là oxit bazơ,tác dụng dễ dãi với axit với oxit axit.
- lúc đun nóng,CuO dễ dẫn đến H2, CO, C khửthành đồng kim loại.
2. Đồng(II) hiđroxit(Cu(OH)2)
- Là hóa học rắn màu xanh, ko tan vào nước.
- có tính bazơ,dễ dàng tan trong số dung dịch axit.
- Dễbị nhiệt độ phân.
3. Muối hạt đồng(II)
- có màu xanh,thường gặp mặt là muối bột đồng(II), như CuCl2, CuSO4, Cu(NO3)2,...
- muối đồng(II) sunfat kết tinh làm việc dạng ngậm nước CuSO4.5H2O bao gồm màu xanh, dạng khan có màu trắng.
+) làm phản ứng của tính oxi hóa
Fe + Cu2+ → Fe2+ + Cu↓
+) công dụng với kiềm:
CuSO4+ 2NaOH→ Na2SO4+ Cu(OH)2
+) công dụng với hỗn hợp NH3:
CuSO4+ 2NH3+ 2H2O→ Cu(OH)2+ (NH4)2SO4
Cu(OH)2+ 4NH3→
+) CuSO4 dung nạp nước hay được sử dụng phát hiện vệt nước trong hóa học lỏng:
CuSO4+ 5H2O→ CuSO4.5H2O (màu xanh)
III. Ứng dụng của đồng với hợp chất của đồng
- phụ thuộc tính dẻo, tính dẫn điện, tính bền và năng lực tạo ra những hợpkim nhưng mà đồngđược áp dụng rộng rãi. Đồng làkimloại màu đặc biệt quan trọng nhất đối với công nghiệp cùng kĩ thuật. Trên 1/2 sản lượng đồng sử dụng làm dây dẫn điện với trên 30% làm cho hợp kim. Hợp kim đồng có không ít ứng dụng trong công nghiệp với đời sống như cần sử dụng để chế tạo các chi tiết máy, chế tạo các thiết bị cần sử dụng trong công nghiệp đóng tàu biển.
- Hợp hóa học của đồng cũng có nhiều ứng dụng. Dung dịchCuSO4dùng trong nntt để chữa dịch mốc sương đến cà chua, khoai tây. CuSO4khan dùng để phát hiện dấu vết của nước trong các chất lỏng. Đồng cacbonat bazơ CuCO3.Cu(OH)2được dùng để pha chế đánh vô cơ màu sắc xanh, màu sắc lục.
Tải thêm tài liệu tương quan đến bài viết Có thể pha trộn Cu bởi các phương thức nào