Đối với vô cơ hay chỉ thực hiện 2 phương pháp: trọng lượng mol vừa phải (M) cùng hóa trị trung bình.
Bạn đang xem: Cách xác định khối lượng mol phân tử thường dùng
1. Phương thức khối lượng mol trung bình (M):
* Khái niệm:
Khối lượng mol vừa đủ (KLMTB) của các thành phần hỗn hợp là trọng lượng của một mol hỗn hợp đó.
Công thức tính KLMTB:
$overline M = fracm_hhn_hh = fracM_1n_1 + M_2n_2 + ... + M_in_in_1 + n_2 + ... + n_ileft( 1 ight)$
Trong kia :
$m_hh$ là tổng thể gam của láo hợp.
$n_hh$là tổng số mol của láo lếu hợp.
$M_1,M_2,M_i$ là trọng lượng mol của các chất trong lếu hợp.
$n_1,n_2,...n_i$ là số mol tương ứng của các chất.
Xem thêm: Cách Uống Nhụy Hoa Nghệ Tây Công Dụng Và Cách Dùng, 12 Cã´Ng DụNg CủA Saffron Vá»I SứC Khá»E
* Đối với chất khí bởi vì thể tích tỉ trọng với số mol đề xuất (1) được viết lại:
$overline M = fracM_1V_1 + M_2V_2 + ... + M_iV_iV_1 + V_2 + ... + V_ileft( 2 ight)$
* Với:$V_1,V_2,...V_i$ theo lần lượt là thể tích những chất khí tương ứng.
Từ (1) cùng (2) suy ra: $overline M = M_1x_1 + M_2x_2 + ... + M_ix_ileft( 3 ight)$
Với là thành phần % số mol hoặc thể tích (nếu hỗn hợp khí) tương ứng của những chất cùng được rước theo số thập phân ( tức là 100% ứng với X = 1).
Chú ý: Nếu hỗn hợp chỉ có hai hóa học có cân nặng mol tương ứng $M_1$ với $M_2$ thì các công thức (1), (2), (3) được viết bên dưới dạng:
(1) suy ra
$overline M = fracM_1n_1 + M_2left( n - n_i ight)n$
(2) suy ra
$overline M = fracM_1V_1 + M_2left( V - V_i ight)V$
(3) suy ra
$overline M = M_1x + M_2left( 1 - x ight)$
Trong đó $n_1,V_1,x$là số mol, thể tích, nguyên tố % về số mol hoặc thể tích (hỗn vừa lòng khí) của hóa học thứ $M_1$.
c. Tính chất:
- $overline M $không phải là hằng số mà có giá trị phụ thuộc vào nguyên tố về lượng các chất trong hỗn hợp.
- $overline M $luôn phía bên trong khoảng cân nặng mol phân tử của chất nhỏ tuổi nhất và béo nhất.
$M_min
- hỗn hợp hai chất A, B bao gồm có nguyên tố tính theo số mol khớp ứng là a%,b% thì:
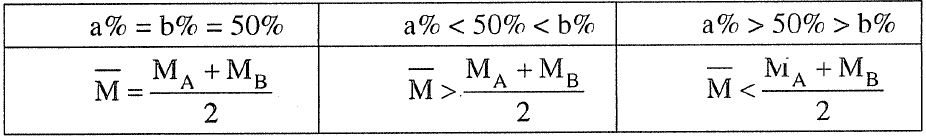
2. Vận dụng trong giải toán:
Trong vô cơ, thường chạm mặt các dạng toán xác định cân nặng nguyên tử của 2 sắt kẽm kim loại thuộc thuộc phân nhóm bao gồm và ở 2 chu kỳ tiếp nối nhau; xác minh thành phần tất cả hổn hợp muối cùng 1 cation hoặc cùng 1 anion; xác định % số lượng mỗi đồng vị 1 nguyên tố; % thể tích các khí trong láo hợp.
* Chú ý: Ngoài cách thức trị số mức độ vừa phải trên ta còn cách thức số phân tử trung bình
$sum olimits_hạt e + p. + n = 2Z + N $
Với các nguyên tử đồng vị bền ($Z le 82$) ta luôn luôn có:
$Z le N le 1,5Z$
Giả sử trong nguyên tử số hạt $n=p=e=Z.$ $sum olimits_hạt = 3overline Z Rightarrow overline Z = sum olimits_hạt /3 Rightarrow Z = $ phần nguyên của $overline Z $.