Khi các phân tử thêm hoặc mất bớt electron trong quá trình phản ứng hóa học, tạo ra các phần tử mang năng lượng điện được gọi là ion (liên kết tĩnh điện). Bản chất của liên kết ion là lực hút tĩnh năng lượng điện giữa 2 ion với điện tích trái dấu. Vậy liên kết ion là gì, được hình thành như vậy nào? nội dung bài viết sau đây sẽ giải đáp câu hỏi này một cách chi tiết nhất.
Bạn đang xem: Nh4cl là liên kết gì
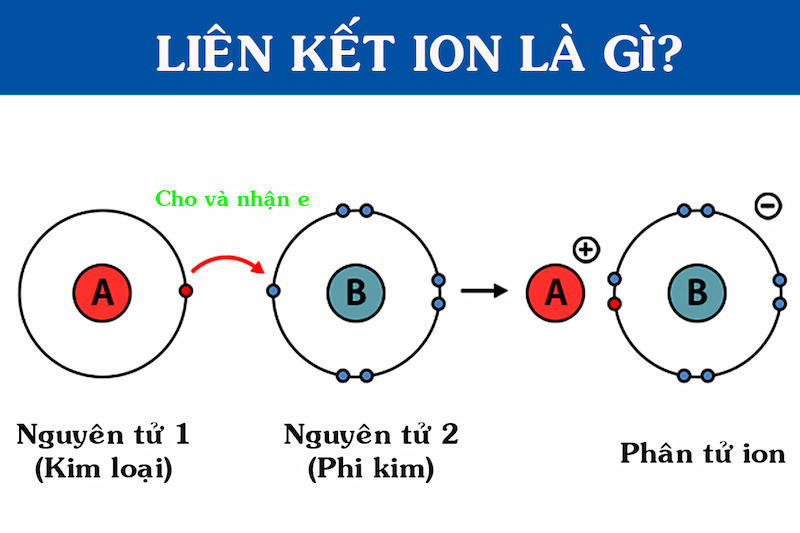
Định nghĩa ion và liên kết ion là gì?
Trong phần này, chúng ta cần vắt chắc phần đa định nghĩa cơ bản về ion, link ion cùng phân nhiều loại của chúng.
Định nghĩa về ion và link ion
Khái niệm Ion: Ion (điện tích) là quá trình một team nguyên tử hay nguyên tử tử bị mất hoặc nhấn thêm một hay các electron.Khái niệm links ion: link ion, hay link điện tích, là một trong liên kết chất hóa học có thực chất là lực hút tĩnh điện giữa nhị ion với điện tích trái dấu. Liên kết ion hay là link giữa các nguyên tử nhân tố phi kim với các nguyên tử yếu tố kim loại. Các nguyên tử kim loại có độ âm điện nhỏ, dễ dàng mất electron tạo thành ion dương. (Theo Wikipedia)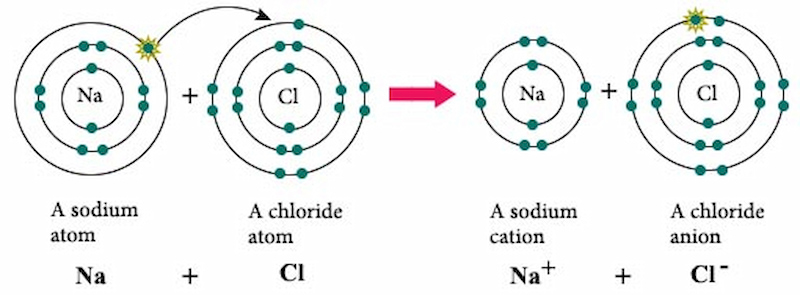
Phân nhiều loại ion dương (cation) và ion âm (anion)
Ion được chia thành 2 một số loại là ion dương cation cùng ion âm anion. Cố thể, trong quá trình ion hóa một nguyên tử hay nhóm nguyên tử vẫn nhận thêm hoặc mất giảm đi các electron tạo thành các cation hoặc anion.
Anion là các ion bao gồm điện tích âm được sinh ra bởi các nguyên tử trung tính. Khi 1 nguyên tử trong quy trình ion hóa hút một hoặc những electron vào vào nó, các ion được hình thành. Thông thường, những anion được hình thành bởi các nguyên tố phi kim, ví dụ như Oxy chế tạo ra thành anion -2, Clo chế tạo thành anion -1,... Do các nguyên tử này còn có độ âm điện khôn cùng lớn, chúng hút những electron và sản xuất thành những anion.
Cation là các ion mang điện tích dương được hiện ra khi những nguyên tử hoặc đội nguyên tử trung tính mất đi những electron. Khi bỏ các electron, số lượng proton trong phân tử nhân cao hơn, vì thế nguyên tử được tích năng lượng điện dương. Những Cation được có mặt từ kim loại tại team S vào bảng tuần trả hóa học. Do các Cation những các kích thước điện tích không giống nhau tùy trực thuộc vào con số electron mất đi cơ mà hình thành lên các Cation khác biệt như: Ca2+, Al3+,...
Ion solo nguyên tử cùng đa nguyên tử là gì?
Ion đơn nguyên tử là ion tất cả duy tốt nhất một nguyên tử, sở hữu điện tích âm hoặc dương. Ví dụ: Mg2+. Al3+, Cl-, F-,...ion đa nguyên tử là ion được tạo thành bởi nhiều nguyên tử link với nhau để sinh sản thành nhóm nguyên tử.Ví dụ: NO3-. SO42-, NH4+,...
Liên kết ion được hình thành như thế nào?
Như chúng ta đã biết, link ion là là liên kết được chế tạo thành bởi vì lực hút tĩnh năng lượng điện giữa các ion sở hữu điện tích trái dấu.
Ví dụ: Na+ + Cl- → Na
Cl. Links giữa Na+ với Cl- là một trong liên kết ion.

Điều kiện hình thành
Liên kết ion chỉ được hiện ra khi có 2 đk sau:
Liên kết được có mặt bởi các nguyên tố bao gồm tính chất khác hẳn nhau (giữa sắt kẽm kim loại và phi kim).
Trừ một số trong những trường hòa hợp điển hình, hiệu độ âm năng lượng điện giữa 2 nguyên tử liên kết ion cần >= 1,7.
Dấu hiệu dìm biết
Chúng ta có thể dựa vào các dấu hiệu tiếp sau đây để phân biệt một liên kết ion:
Phân tử hợp chất được sinh ra từ kim loại điện hình mang đến phi kim điển hình. Ví dụ: Na
Cl, Ca
Cl2, Ba
F2,... Những hợp chất này mọi chứa links ion- links được xuất hiện giữa anion phi kim với anion kim loại.
Phân tử cất hợp chất muối với cation hoặc anion nhiều nguyên tử.
Ví dụ: Mg
SO4, NH4Cl,... Đây đa số là link ion - liên kết này được xuất hiện giữa anion phi kim cùng cation kim loại và anion nơi bắt đầu axit.
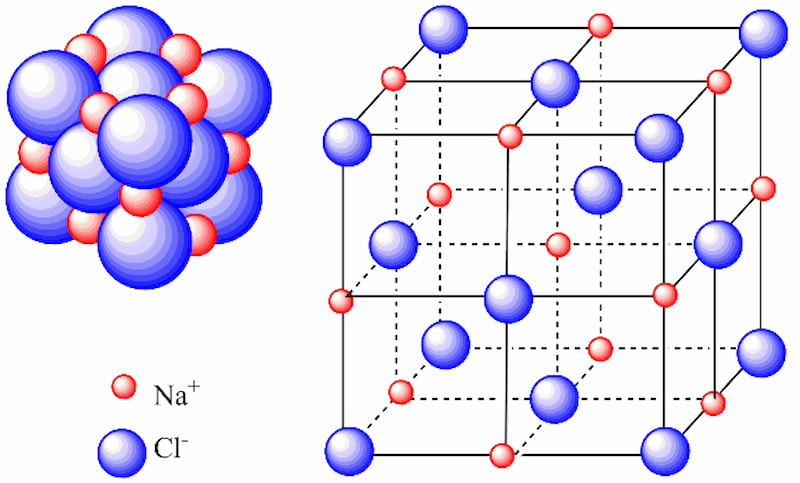
Cấu trúc mạng tinh thể của link ion
Cấu trúc mạng tinh thể của links ion là sự kết hợp của không ít phân tử ion thành một link khổng lồ. Và sự bố trí theo một kết cấu hình học này được hotline là mạng tinh thể.
Ví dụ: Na
Cl không đựng một ion Na và một ion Cl, links ion này là việc sắp xếp của đa số ion Na+ và Cl- thành mạng lưới tinh thể, có tỉ lệ 1-1.
Tính chất của hợp chất có links ion
Từ đặc thù của liên kết ion rất có thể thấy rằng, những hợp hóa học có link ion đang thường mang đông đảo tính chất phổ cập như:
Trạng thái: chất rắn ion mãi mãi ở nhiệt độ phòng với ở dạng tinh thể.
Cấu trúc: thường thì ion được sắp xếp theo cấu tạo mạng tinh thể.
Tính dẫn điện: Ở tinh thể rắn, ion ko dẫn điện, nhưng mà ở dạng hỗn hợp thì dẫn điện.
Dễ đổ vỡ khi gặp gỡ áp lực: lúc bị đặt dưới áp lực, các hợp chất của ion dễ dàng vỡ đồng thời link bị phá vỡ lẽ dọc theo các mặt phẳng.
Lực hút tĩnh điện: liên kết ion là link có lực hút tĩnh năng lượng điện mạnh. Bởi vì đó, hợp hóa học ion thường được biết đến là hết sức cứng, nhiệt độ nóng chảy và nhiệt độ sôi cao do liên kết ion tương đối bền vững. Ví dụ: Na
Cl có ánh nắng mặt trời nóng tung là 800 độ, Mg
O là 2800 độ.
Dẫn điện: Ở trạng thái lạnh chảy cùng khi rã trong dung dịch. Ở tâm trạng rắn thường xuyên không dẫn điện.
Monkey Math - Ứng dụng học toán tiếng Anh chỉ cách 2K/Ngày
Sự điện li là gì? định hướng và giải bài bác tập đưa ra tiết
Số thoái hóa là gì? 4 quy tắc khẳng định số oxi hóa của một nguyên tố
Liên kết ion và links cộng hóa trị không giống nhau như nạm nào?
Đều là link xảy ra trong quy trình phản ứng hóa học, nhưng đâu là sự khác hoàn toàn giữa link ion với liên kết cộng hóa trị?
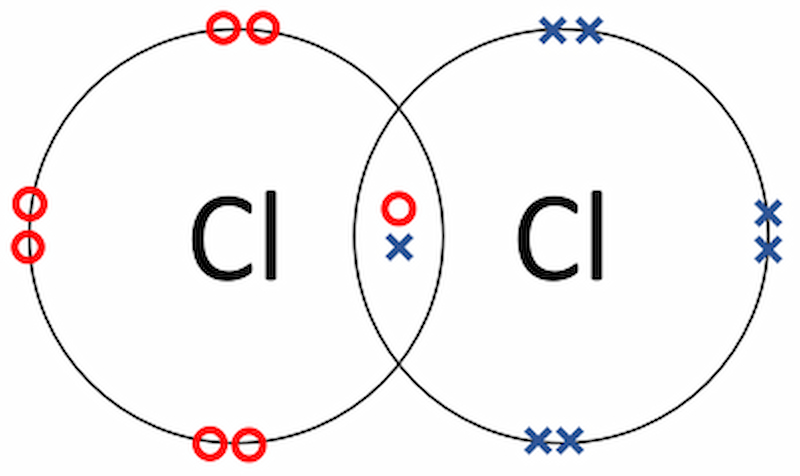
Chúng ta cùng khám phá sự không giống nhau này trải qua định nghĩa, thực chất liên kết và hiệu độ âm năng lượng điện trong bảng đối chiếu sau:
Hướng dẫn giải một số trong những bài tập về link ion SGK hóa học 10 kèm lời giải
Cùng áp dụng những kỹ năng và kiến thức đã học tập trên nhằm thực hành một số trong những bài tập hóa học 10 về link ion sau đây:
Bài 1 (trang 59 SGK Hóa 10):
Liên kết hóa học trong Na
Cl được hiện ra là do:
A. Hai hạt nhân nguyên tử hút electron siêu mạnh.
B. Mỗi nguyên tử Na cùng Cl góp tầm thường 1 electron.
C. Mỗi nguyên tử kia nhường hoặc thu electron để trở thành những ion trái vệt hút nhau.
D. Mãng cầu → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → Na
Cl.
Chọn giải đáp đúng nhất
Đáp án: D đúng
Bài 2 (trang 59 SGK Hóa 10):
Muối ăn uống ở thể rắn là:
A. Những phân tử Na
Cl
B. Các ion Na+ cùng Cl-
C. Các tinh thể hình lập phương: những ion Na+ cùng Cl- được phân bổ luân phiên gần như đặn trên mỗi đỉnh.
D. Các tinh thể hình lập phương: các ion Na+ với Cl- được phân bổ luân phiên các đặn thành từng phân tử riêng rẽ.
Chọn đáp án đúng nhất.
Đáp án: C đúng
Bài 3 (trang 60 SGK Hóa 10):
a) Viết cấu hình electron của cation liti (Li+) và anion oxit (O2-).
b) các điện tích ở ion Li+ với O2- vì đâu nhưng có?
c) Nguyên tử khí hi hữu nào có thông số kỹ thuật electron như là Li+ cùng nguyên tử khí hi hữu nào có cấu hình electron tương tự O2-.
d) bởi vì sao 1 nguyên tử oxi phối hợp được cùng với 2 nguyên tử liti?
Đáp án:
a) thông số kỹ thuật electron của cation liti (Li+) là 1s2 và anion oxit (O2-) là 1s22s22p6.
b) Điện tích nghỉ ngơi Li+ vì mất 1e cơ mà có, điện tích ở O2- bởi vì O thừa nhận thêm 2e mà có.
c) Nguyên tử khí hiếm He có cấu hình electron tương đương Li+
Nguyên tử khí thảng hoặc Ne có cấu hình electron tương đương O2-
d) do mỗi nguyên tử liti chỉ có thể nhường 1e, mà một nguyên tử oxi thu 2e.
2Li → 2Li+ + 2e;
O + 2e → O2-;
2Li+ + O2- → Li2O.
Bài 4 (trang 60 SGK Hóa 10):
Đề bài:
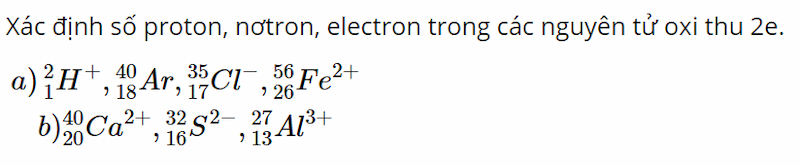
Lời giải:
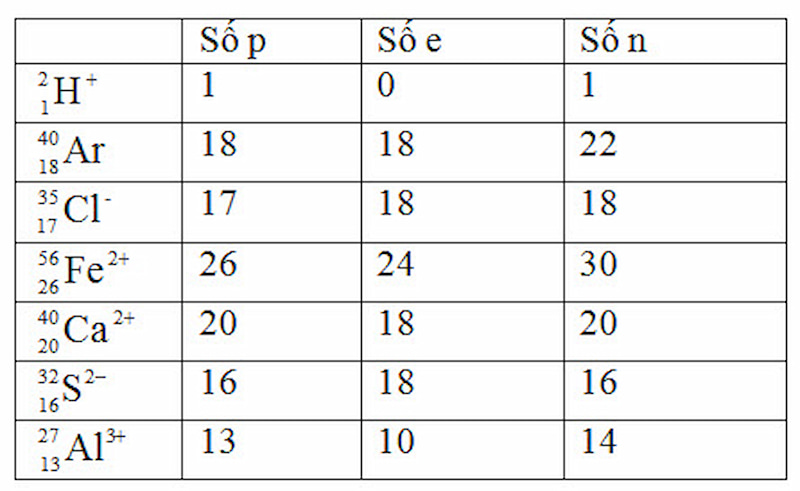
GIÚP nhỏ HỌC TOÁN KẾT HỢP VỚI TIẾNG ANH SIÊU TIẾT KIỆM CHỈ TRÊN MỘT ứng dụng MONKEY MATH. VỚI NỘI DUNG DẠY HỌC ĐA PHƯƠNG PHÁP GIÚP BÉ PHÁT TRIỂN TƯ DUY NÃO BỘ VÀ NGÔN NGỮ TOÀN DIỆN CHỈ VỚI 2K/NGÀY.  |
Bài tập về link ion để học sinh thực hành
Ngoài bài tập vào sách giáo khoa chất hóa học 10, dưới đó là một số bài bác tập tương quan mà Monkey tổng hợp để các em cùng nhau luyện tập:
I/ PHẦN TRẮC NGHIỆM
Câu 1:Liên kết ion là links hóa học tập được hình thành bằng lực hút tĩnh điện giữa
A. Anion với electron từ bỏ do
B. Những ion có điện tích thuộc dấu
C. Phân tử nhân của nguyên tử này cùng hạt nhân của nguyên tử kia
D. Cation cùng anion
Câu 2:Loại phân tử nào sau đây tham gia vào quy trình liên kết hóa học?
A. Hạt electron
B. Phân tử notron
C. Phân tử proton
D. Hạt nhân nguyên tử
Câu 3:Liên kết ion được tạo thành giữa
A. Hai nguyên tử kim loại.
B. Nhị nguyên tử phi kim.
C. Một nguyên tử sắt kẽm kim loại mạnh và một nguyên tử phi kim mạnh.
D. Một nguyên tử sắt kẽm kim loại yếu và một nguyên tử phi kim yếu.
Câu 4:Dãy chất nào dưới đây mà phân tử chỉ chứa liên kết ion?
A. KCl; Mg
O; Ba
Cl2
B. Ba
Cl2; Mg
O; H2O
C. Na
Br; Na2O; KNO3
D. SO2; H2SO4; HCl
O4
Câu 5:Trong tinh thể Na
Cl, nhân tố Na cùng Cl sinh sống dạng ion và bao gồm sô electron thứu tự là
A. 10 cùng 18
B. 12 và 16
C. 10 và 10
D. 11 cùng 17
Câu 6:Mạng tinh thể ion có đặc tính nào bên dưới đây?
A. Bền vững, ánh sáng nóng tan cao và ánh nắng mặt trời sôi thấp
B. Bền vững, ánh nắng mặt trời nóng tan và nhiệt độ sôi hơi cao
C. Bền vững, nhiệt độ nóng và ánh sáng sôi thấp
D. Dễ cất cánh hơi
Câu 7:Phân tử nào dưới đây có liên kết phân rất nhất?
A. F2O
B. Cl2O
C. Cl
F
D. O2
Câu 8:Phát biểu như thế nào sau đó là không đúng?
A. Liên kết ion là link được tạo thành bởi vì sự nhấn electron
B. Links ion là link giữa 2 nguyên tử gồm hiệu độ âm điện to hơn 1
C. Links ion là link được hình thành vị sự góp phổ biến electron.
D. Liên kết ion được ra đời nhờ lực hút tĩnh năng lượng điện giữa ion sở hữu điện tích trái dấu
Câu 9:Liên kết trong phân tử hóa học nào tiếp sau đây mang nhiều đặc điểm của liên kết ion nhất?
A. Li
Cl
B. Na
Cl
C. KCl
D. Cs
Cl
Câu 10:Năng lượng ion hóa của nguyên tử là:
A. Năng lượng giải phóng vày nguyên tử khi tạo links ion
B. Năng lượng giải phóng lúc nguyên tử thừa nhận thêm electron
C. Năng lượng cần để tách electron thoát ra khỏi nguyên tử ngơi nghỉ trạng thái cơ bản
D. Tích điện cần để hỗ trợ để nguyên tử thừa nhận thêm electron
II/ PHẦN TỰ LUẬN
Câu 1.Hãy viết cách làm electron với công thức kết cấu của các phân tử sau: PH3, SO2
Câu 2.Viết cách làm electron, công thức cấu trúc của HCl
O, HCN, HNO2.
Câu 3.Viết công thức cấu tạo của các phân tử cùng ion sau: H2SO3, Na2SO4, HCl
O4, Cu
SO4, Na
NO3, CH3COOH, NH4NO3, H4P2O7.
Câu 4. Xem thêm: Khu chung cư linh đàm - tổng quan về chung cư hh linh đàm
Câu 5.Viết công thức cấu trúc của các phân tử và ion sau: NH4+, Fe3O4, KMn
O4, Cl2O7
Câu 6.Viết công thức electron với công thức kết cấu các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2Cr
O4, PCl5
Câu 7: khẳng định số oxi hóa của các nguyên tố vào hợp chất , solo chất cùng ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HCl
O, Na
Cl
O2, HCl
O3.
c) Mn, Mn
Cl2, Mn
O2, KMn
O4.
Cho các phân tử sau : C2H2(1) ; BF3(2) ; Be
Cl2(3) ; C2H4(4) ; CH4(5) ; Cl2(6) ; H2(7) ; H2O (8) ; NH3(9) ; HCl (10). Trong những phân tử trên, sự hiện ra liên kết trong các phân tử nhờ :
a. Sự lai hoá sp các AO hoá trị là :
A. (1), (3), (6).
B. (1), (2), (3), (5).
C. (1), (3), (4), (7).
D. (1), (3).
b. Sự lai hoá sp2 các AO hoá trị là :
A. (2), (4).
B. (2), (6).
C. (2), (3), (4).
D. A, B, C.
b. Sự lai hoá sp3 những AO hoá trị là :
A. (5), (6), (8), (10).
B. (5), (8), (9).
C. (3), (5), (8), (9).
D. (5), (6), (8), (9).
Câu 8: Cho độ âm năng lượng điện Cs : 0,79 ; tía : 0,89 ; H : 2,2 ; Cl : 3,16 ; S : 2,58 ; N : 3,04 ; O : 3,44 nhằm xét sự phân rất của liên kết trong phân tử các chất sau: NH3, H2S, H2O, Cs
Cl . Hóa học nào trong các chất bên trên có links ion ?
Câu 9: X, A, Z là số đông nguyên tố có số năng lượng điện hạt nhân là 9, 19, 8.
a) Viết thông số kỹ thuật electron nguyên tử của những nguyên tố đó.
b) Dự đoán links hóa học rất có thể có giữa những cặp X cùng A, A và Z, Z cùng X.
Câu 10: Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có link ion ?
Với vấn đề sở hữu Kho trò nghịch và video, giọng đọc, hình ảnh minh họa sinh động, hấp dẫn. Luôn luôn đổi mới, update thường xuyên - tăng hào hứng học đến trẻ lúc học tiếng Anh thuộc Monkey Junior chưa đến 2K/ngày.  |
Bài viết trên trên đây đã cung ứng những lý thuyết chi tiết nhất về liên kết ion cùng bài xích tập thực hành trong SGK chất hóa học 10. Hy vọng bạn tất cả thêm nhiều kiến thức có ích xung quanh ion, links ion và quá trình tiếp thu bài học kinh nghiệm hiệu quả. Truy cập website của Monkey từng ngày để sở hữu thêm nhiều tin tức thú vị về môn chất hóa học nhé!
Trong cuộc sống, Amoni clorua-NH4Cl là 1 trong những hợp hóa học vô cơ vô cùng thông dụng và bao gồm vai trò cực kỳ quan trọng. Cũng chính vì điều này, tin tức về Amoni Clorua là rất đề xuất thiết. Trong nội dung bài viết này, Hút Bể Phốt Khoáng sẽ cung cấp cho quý vị đầy đủ thông tin đặc trưng nhất về Amoni Clorua, bao gồm tính hóa học vật lý, tính chất hóa học tập và áp dụng của nó trong cuộc sống và thêm vào công nghiệp. Bạn sẽ có một cái nhìn toàn diện về tất cả những gì cần phải biết về Amoni Clorua trong nội dung bài viết này.
Amoni Clorua – NH4Cl là gì?

Amoni clorua (NH4Cl) là một trong những hợp hóa học muối vô cơ, có màu trắng và hoàn toàn có thể hòa tan trong nước. Đây là 1 trong chất tất cả tầm đặc trưng trong đời sống và cung cấp công nghiệp, được sử dụng trong nhiều ứng dụng khác nhau.
Ngoài tên thường gọi thông thường, Amoni clorua còn được nghe biết với các tên thường gọi khác như muối bột lạnh, ammonium chloride, phân clorua amon, salt ammoniac, Nushadir Salt, Ammonium Muriate.
Tính chất cấu trúc của Amoni Clorua
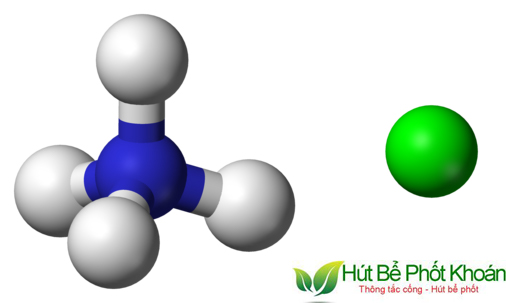
Công thức chất hóa học của Amoni Clorua là NH4Cl, màn trình diễn cho một phân tử có ion Amonium (NH4+) và ion clorua (Cl-).
Cấu trúc phân tử nhân của ion amonium gồm 1 nguyên tử nitơ links với tư nguyên tử hydro, tạo ra thành một hình chữ nhật ko đối xứng. Trong lúc đó, ion clorua là 1 trong ion hóa trị âm được tạo ra bởi vấn đề thêm một electron vào nguyên tử clo (Cl), chế tạo ra thành ion có cấu tạo hình cầu.
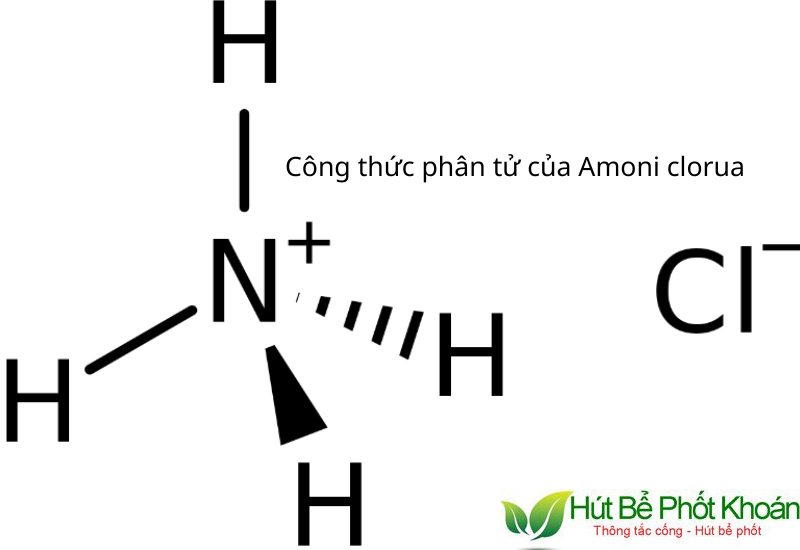
Tính chất vật lý của NH4Cl gồm một số đặc điểm như sau:
Dạng vật dụng chất: NH4Cl là một trong chất rắn tinh thể màu trắng.Điểm nóng chảy: 338 độ C.Điểm sôi: 520 độ C.Tan vào nước: NH4Cl có công dụng hòa chảy trong nước và có mặt ion amonium với ion clorua.Độ hút ẩm: NH4Cl có công dụng hút độ ẩm cao, thường xuyên được sử dụng để hấp thụ nhiệt độ trong không khí.Tổng thể, NH4Cl là một trong những hợp chất muối vô sinh với tính chất vật lý cùng hóa học nhiều mẫu mã và có tương đối nhiều ứng dụng trong cuộc sống và công nghiệp.
Tính hóa chất của Nh4Cl
Những đặc điểm hóa học tập của NH4Cl bao gồm:
Tính acid: NH4Cl gồm tính acid lúc hoà rã trong nước, cho ra ion H+ cùng ion Cl-. Phương trình hóa học: NH4Cl + H2O -> NH4+ + Cl- + H+Tính bazơ: NH4Cl có khả năng chức năng với bazơ yếu, tạo thành amoni (NH3) cùng nước. Phương trình hóa học: NH4Cl + NaOH -> NH3 + Na
Cl + H2OTính oxi hóa: NH4Cl có công dụng bị oxi hóa thành những sản phẩm khác nhau tùy trực thuộc vào đk phản ứng. Ví dụ, khi nung NH4Cl với oxi, ta thu được thành phầm là HCl với N2. Phương trình hóa học: 4NH4Cl + 3O2 -> 2N2 + 4H2O + 4HClTính khử: NH4Cl tất cả tính khử lúc được nấu nóng với kim loại kiềm (như Na), tạo thành amoni và sắt kẽm kim loại clorua. Phương trình hóa học: 2NH4Cl + 2Na -> 2NH3 + 2Na
Cl + H2Tính chất tạo phức: NH4Cl có công dụng tạo phức với những ion kim loại như Fe2+, Cu2+,… Phương trình hóa học: 2NH4Cl + Cu
SO4 -> Cu(NH3)4SO4 + 2HCl.
Cách điều chế Amoni Clorua
Amoni clorua có thể được điều chế bằng cách trộn axit clohidric (HCl) và khí amoniac (NH3) vào một bình kín. Quy trình phản ứng sẽ tạo ra muối hạt amoni clorua (NH4Cl) với cũng hoàn toàn có thể sinh ra một lượng bé dại muối amoni clorua hydro clorua (NH4Cl.HCl). Phản ứng được thể hiện bởi phương trình chất hóa học sau: NH3(g) + HCl(g) → NH4Cl(s)Tìm thấy NH4Cl thoải mái và tự nhiên xung quanh những vùng tất cả núi lửa, được ra đời trên những tảng đá núi lửa sát với những lỗ thông khí thải.Công nghệ Solvay cũng cho phép thu được NH4Cl từ quá trình phản ứng của CO2, 2NH3, 2NaCl cùng H2O: CO2 + 2NH3 + 2Na
Cl + H2O → 2NH4Cl + Na2CO3.Ngoài ra, NH4Cl cũng hoàn toàn có thể được chế tạo từ quy trình sản xuất gas coke, phân hủy hóa học hữu cơ và các quy trình khai thác khoáng sản.
Ứng dụng của Amoni Clorua vào cuộc sống

Amoni Clorua (NH4Cl) có rất nhiều ứng dụng trong đời sống bé người, một vài ứng dụng phổ biến bao gồm:
Sản xuất thuốc: NH4Cl được thực hiện để điều chế nhiều loại thuốc khác nhau, bao hàm thuốc ho, thuốc kháng sinh và thuốc bớt đau.Hóa hóa học công nghiệp: NH4Cl là 1 thành phần thông dụng trong nhiều sản phẩm hóa chất công nghiệp, bao hàm các phân bón và thuốc trừ sâu.Dung môi hóa học: NH4Cl được áp dụng làm dung môi trong một trong những quy trình hóa học.Dung dịch làm lạnh: NH4Cl được áp dụng để tạo ra các dung dịch làm cho lạnh, được sử dụng trong số thiết bị làm cho lạnh, tủ đông với tủ mát.Xử lý nước thải: NH4Cl được áp dụng để xử trí nước thải, giúp sa thải các chất ô nhiễm và khử mùi.Điện phân: NH4Cl được sử dụng làm năng lượng điện phân trong quy trình sản xuất các kim loại như kẽm cùng thiếc.NH4Cl (Amoni Clorua) còn được áp dụng trong một số nghành nghề khác như sau:Trong ngành tiếp tế pin: NH4Cl được áp dụng làm chất điện lyte sẽ giúp cho pin chuyển động ổn định và kéo dãn dài tuổi thọ.Trong ngành phân phối thuốc: NH4Cl được áp dụng làm chất suport trong quy trình sản xuất thuốc, giúp tăng cường mức độ bền và công dụng của thuốc.Trong ngành sản xuất thực phẩm: NH4Cl được áp dụng làm chất tạo men cùng chất điều chỉnh độ pH trong quy trình sản xuất bánh mỳ và các thành phầm bột mì khác.Trong ngành thêm vào cao su: NH4Cl được áp dụng làm hóa học tạo đặc và chất kiểm soát và điều chỉnh độ p
H trong quá trình sản xuất cao su.Trong ngành thêm vào giấy: NH4Cl được áp dụng làm hóa học tạo đặc với chất điều chỉnh độ p
H trong quy trình sản xuất giấy.Trong ngành cung cấp sơn: NH4Cl được thực hiện làm chất kiểm soát và điều chỉnh độ p
H và chế tác độ nhớt trong quy trình sản xuất sơn.Trong ngành tiếp tế mực in: NH4Cl được sử dụng làm hóa học tạo độ nhớt cùng chất kiểm soát và điều chỉnh độ p
H trong quá trình sản xuất mực in.
Lưu ý khi áp dụng và bảo quản Nh4Cl
Khi sử dụng và bảo vệ NH4Cl (Amoni Clorua), cần để ý những điểm sau đây:
Bảo quản vị trí khô ráo, thoáng mát, tránh ánh nắng trực tiếp.Tránh tiếp xúc với các chất oxy hóa, axit, kiềm và các chất dễ cháy nổ khác.Tránh hít yêu cầu bụi hoặc hơi NH4Cl, sử dụng khẩu trang và bức xúc tay đảm bảo an toàn khi buộc phải thiết.Không được uống hoặc ăn NH4Cl vị nó có thể gây gian nguy đến sức khỏe.Sử dụng NH4Cl trong môi trường có độ thông gió giỏi để kị ngộ độc.Tránh làm hỏng bao bì chứa NH4Cl để tránh bị thất thoát hoặc tràn ra ngoài.Khi phải sử dụng, phải tuân thủ tương đối đầy đủ các hiện tượng về bình an lao cồn và bảo vệ môi trường.Tổng kết lại, amoni clorua (NH4Cl) là 1 trong những hợp hóa học hóa học có tương đối nhiều ứng dụng trong cuộc sống con bạn và công nghiệp. Nó được thực hiện để điều chế nhiều hợp hóa học hữu cơ, trong cung ứng thuốc, phân bón, làm cho sạch mặt phẳng kim loại, với cả vào công nghiệp in với nhuộm. Tuy nhiên, như sẽ đề cập, NH4Cl là một trong những chất ăn mòn và tổn hại cho môi trường nếu sử dụng sai bí quyết hoặc vô tình thải ra ngoài. Vày đó, khi áp dụng và bảo quản, cần vâng lệnh các quy định an ninh và bảo đảm môi trường. Nếu khách hàng đang chạm mặt vấn đề về hố ga, bể phốt, bạn có thể liên hệ với đơn vị chức năng Hút Bể Phốt Khoán để được tư vấn và hỗ trợ công dụng nhất.