1. Phi kim là gì
“Học, học tập nữa, học mãi” là quy trình đời người luôn tìm kiếm kỹ năng và kiến thức mới mẻ, không ngừng mở rộng nhân sinh. Và tất nhiên, so với mỗi một họ đều đã có lần là học viên ngồi trên ghế bên trường buổi tối thiếu là 12 năm học. Trong những môn học tập thì theo hiện tại học sinh đa phần đều sợ độc nhất vô nhị hoá – theo chúng ta nói là khó nhai. Bởi vì vậy, để giúp phần nào cho các mầm non của bọn chúng ta. Hãy cùng Wise
Viet
Nam tò mò lại về đặc thù hoá học tập của phi kim. Tuy nhiên trước không còn hay gọi lại phi kim là gì?
Hay nói đúng đắn hơn là phi kim loại. Đây là một trong nguyên tố hóa học thường xuyên thiếu tính chất kim các loại chiếm ưu thế. Chúng bao hàm từ khí ko màu (như hydro ) đến hóa học rắn sáng bóng và nhiệt độ nóng rã cao (như bo). Các electron trong phi kim vận động khác với những electron vào kim loại. Với một số trong những trường hợp ngoại lệ, các phi kim được cố định và thắt chặt tại chỗ, dẫn đến những phi kim hay dẫn nhiệt với điện kém với giòn hoặc tan vỡ vụn khi ở tâm lý rắn.
Bạn đang xem: Phi kim và kim loại
Nguyên tử phi kim có giá trị tự trung bình cho cao về độ âm điện, chúng có xu thế hút electron trong số phản ứng hóa học và chế tạo ra thành những hợp chất gồm tính axit.
Thuật ngữ phi kim loại có từ ít nhất là năm 1566, không có định nghĩa đúng chuẩn nào được thống nhất thoáng rộng về phi kim. Một vài nguyên tố bao gồm sự pha trộn rõ rệt của những tính chất sắt kẽm kim loại và phi kim loại; trường phù hợp nào trong các các ngôi trường hợp đường biên này được tính là phi kim có thể khác nhau tùy ở trong vào tiêu chí phân loại. Mười tư nguyên tố luôn luôn được thừa nhận là phi kim và thỉnh thoảng được thêm vào lúc chín yếu tắc nữa, như biểu thị trong bạn dạng trích lục bảng tuần trả kèm theo.

2. đặc điểm chung của phi kim loại
Trước khi đi sâu rộng vào tính chất hoá học tập của phi kim loại, ta kể lại trước về đặc điểm chung của bọn chúng để đẳng cấp rõ rộng được phần làm sao về phi kim.
Tính chất đặc trưng cơ bạn dạng nhất của phi kim là tích điện ion hóa khủng và độ âm năng lượng điện lớn. Do những tính năng này, các phi kim loại thường chiếm được electron lúc phản ứng với những hợp hóa học khác, chế tác thành liên kết cộng hóa trị.
Nguyên tử của phi sắt kẽm kim loại có xu hướng nhỏ dại hơn nguyên tử của kim loại.
Các phi kim loại có độ âm năng lượng điện lớn, hay có xu thế hút các electron hơn so với đầy đủ gì chúng thông thường có.
3. đặc điểm hóa học tập của phi kim
Quay lại nhà đề thiết yếu về đặc thù hoá học tập của phi kim. Các đặc thù này thường biểu hiện ra lúc phi kim bội phản ứng với nước, kim loại, bazơ, Oxi.
Phi kim bội phản ứng cùng với nước:Một phi sắt kẽm kim loại không bội nghịch ứng cùng với nước tuy nhiên nó hay phản ứng rất mạnh khỏe trong không khí, đó là tại sao tại sao một số trong những chúng được tàng trữ trong nước. Ví dụ, trong số những phi kim loại có bội nghịch ứng cao là phốt pho cùng nó bắt lửa lúc tiếp xúc với ko khí, đó là vì sao tại sao nó được tàng trữ trong nước để ngăn cản sự tiếp xúc của nó với oxy vào khí quyển.
Phi kim bội nghịch ứng cùng với Axit:Không gồm phi kim loại nào làm phản ứng với axit.
Phi kim phản bội ứng cùng với bazơ:Phản ứng thân phi sắt kẽm kim loại và bazơ là 1 trong những phản ứng khôn cùng phức tạp. Bội nghịch ứng của clo với những bazơ như natri hiđroxit tạo nên các thành phầm như natri hipoclorit, natri clorua cũng như nước.
Cl2 + 2Na0H → Na
Cl + H2O + Na
Cl
O
Oxit của phi kim loại được chế tạo ra thành khi nó bội nghịch ứng cùng với oxy. Các oxit của phi sắt kẽm kim loại có bản chất là axit hoặc trung tính. Lấy ví dụ như như:
Khi lưu hoàng phản ứng với oxy, chúng ta nhận được lưu hoàng đioxit.
S + O2 → SO2
Khi lưu huỳnh đioxit làm phản ứng với nước, nó chế tác thành axit giữ huỳnh.
SO2 + H2O → H2SO3
Phi kim phản ứng với kim loại:Phi sắt kẽm kim loại phản ứng với kim loại, thường tạo nên thành những hợp hóa học ion.
Na + Cl → Na
Cl
4. Danh sách các chất phi kim
Sau khi đang biết về tính chất hoá học của phi kim, hãy cùng Wise
Viet
Nam công ty chúng tôi điểm lại về list những chất biết đến phi kim loại.
| Phi kim loại | Trạng thái ở ánh nắng mặt trời phòng | Biểu tượng |
| Hydrogen | Khí | H |
| Nitơ | Khí | N |
| Ôxy | Khí | O |
| Flo | Khí | F |
| Clo | Khí | Cl |
| Brôm | Chất lỏng | Br |
| Iốt | Chất rắn | Tôi |
| Carbon | Chất rắn | C |
| Lưu huỳnh | Chất rắn | S |
| Phốt pho | Chất rắn | P |
| Silicon | Chất rắn | Si |
Hai phi kim: hydro và heli chiếm khoảng chừng 99% vật dụng chất thông thường trong vũ trụ quan tiếp giáp được theo khối lượng. Năm yếu tố phi kim loại, hydro, carbon, nitơ, oxy với silicon, nhiều phần tạo yêu cầu vỏ Trái đất, bầu khí quyển, biển khơi và sinh quyển. Hầu hết các phi kim bao gồm vai trò hoặc công dụng sinh học, công nghệ, trong nước. Các sinh thiết bị sống được kết cấu gần như hoàn toàn từ những phi kim hydro, oxy, carbon và nitơ. Gần như toàn bộ các phi kim có ứng dụng riêng vào y học và chế tác sinh học ; laser cùng ánh sáng; và các vật dụng gia đình.
5. Ứng dụng của phi kim loại
4.1 Để pha trộn amoniac, axit nitric cùng phân bón, fan ta thực hiện nitơ.
4.2 Để có tác dụng sạch nước, clo được sử dụng.
4.3 Hydro rất bổ ích làm nhiên liệu đến tên lửa.
4.4 Carbon hoàn toàn có thể được sử dụng để gia công bút chì lúc nó nghỉ ngơi dạng than chì.
4.5 Axit sunfuric được điều chế bằng cách sử dụng lưu huỳnh.
Ngoài ra, trong cuộc sống thường ngày hàng ngày:
4.6 quá trình hô hấp được cung cấp bởi oxy, chiếm 21% thể tích. Nó cũng khá được sử dụng để triển khai thép và duy trì nhiệt độ cao trong thừa trình sản xuất kim loại. Trong bệnh dịch viện, bình oxy được sử dụng. Là 1 hóa hóa học ( van vật liệu nhựa hóa chất ) tẩy trắng, clo có kết quả để sa thải các vết bẩn và mảng màu. Clo được thực hiện để chế tạo nhiều các loại polyme cùng thuốc trừ sâu. Nó hỗ trợ lọc nước. Có tác dụng sao? vi khuẩn bị tàn phá khi đến clo vào nước uống. Đối với các thí nghiệm khoa học, heli được áp dụng như một khí trơ. Sạn bong bóng thời máu cũng sử dụng nó. Iốt được thực hiện như một chất khử trùng trong chữa bệnh vết thương cùng vết cắt, cũng như trong chữa bệnh nhiễm trùng cổ họng.
4.7 Phân bón: Nitơ bao gồm trong phân bón. Nó cung ứng sự trở nên tân tiến của thực vật. Nó shop tốc độ cách tân và phát triển của cây. Thực đồ dùng cũng có thể được hưởng thụ từ phốt pho phi kim loại. Nhì phi kim này rất cần thiết cho sự cách tân và phát triển của thực vật.
Phi kim là gì? đặc điểm vật lý? tính chất hóa học? những phi kim hay gặp?Ứng dụng của phi kim?
Bài tập vận dụng?
Bạn bao gồm đang đau đầu do những loài kiến thức lớn lao của môn hóa học? Khái niệm, đặc điểm vật lý, đặc thù hóa học và bài tập áp dụng dày cộm. Từ bây giờ hãy để chúng tôi giúp chúng ta ôn tập lại kỹ năng phần phi kim – trong những phần trung tâm nhất.
1. Phi kim là gì?
Phi kim là mọi nguyên tố ở phía bên cần bảng tuần hoàn hóa học, thường xuyên tồn tại ngơi nghỉ dạng phân tử. Bọn chúng là rất nhiều nguyên tố hóa học dễ nhấn electron, ngoại từ hidro. Đa số các phi kim đầy đủ không dẫn điện, một vài nguyên tố có sự biến đổi tính.2. đặc điểm vật lý:
Ở điều kiện thường, phi kim tồn tại sinh hoạt cả tía trạng thái: tâm lý rắn như lưu giữ huỳnh, cacbon, photpho …;trạng thái lỏng như brom; tâm lý khí như oxi, nitơ, hiđro, clo …
Phần lớn những nguyên tố phi kim các không dẫn được điện, dẫn nhiệt cùng có nhiệt độ nóng tung thấp. Một vài phi kim vô cùng độc như clo, brom, iot.
3. đặc thù hóa học:
3.1. Tác dụng với kim loại:
Nhiều phi kim tác dụng với kim loại tạo thành muối:

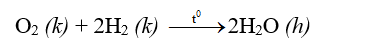
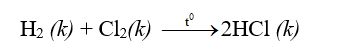
Nhiều phi kim chức năng với oxi chế tạo thành oxit axit.
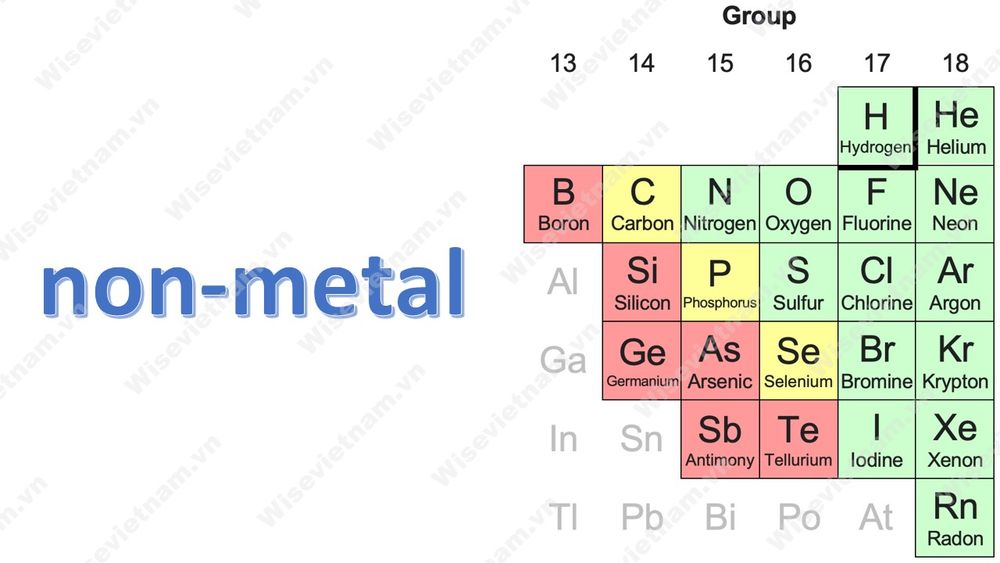
4. Các phi kim hay gặp:
Phi kim trường thọ khá đa dạng mẫu mã và phổ biến, phần đông dạng phi kim thường chạm chán bao gồm: C, O, H, S, P, N, Cl, Br, I, F……
5. Ứng dụng của phi kim:
Đơn hóa học phi kim tất cả vai trò quan trọng trong việc tạo những phản ứng tổng hợp với các hợp chất khác để tạo thành sản phẩm.
Oxy: Oxy tất cả hai công dụng quan trọng vào cuộc sống, chính là hô hấp cùng nó được dùng làm đốt cháy nhiên liệu. Oxy rất quan trọng cho sự sống của tất cả con fan và đụng vật. Thợ lặn, công ty thám hiểm biển… lúc xuống đại dương đều phải thực hiện bình chăm sóc khí quánh biệt; xăng cháy vào oxy tạo ra nhiệt độ cao hơn nữa trong ko khí. Trong tiếp tế gang thép, bạn ta thổi oxy vào lò để tạo ánh sáng cao, cải thiện hiệu trái và quality của thành phẩm.
Nitơ: Nitơ được dùng trong đóng gói bảo vệ thực phẩm, luyện kim, hàn con đường ống, bơm lốp ô tô, vật dụng bay…
Clo: cần sử dụng trong pha trộn nước – mạch, clorua vôi, tẩy white vải, bột giấy, pha trộn nhựa PVC, cao su…
Lưu huỳnh:
Vai trò:
Tham gia vào quá trình hình thành protein, hormone, insulin.
Tẩy trắng, khử chì, thủy ngân.
Khử trùng phòng cho tất cả những người mắc bệnh truyền nhiễm.
Tham gia quy trình giải độc cùng oxy hóa trong cơ thể.
Thực phẩm đựng được nhiều lưu huỳnh như hải sản, hành, tỏi, dầu thực vật, thịt, trứng, phân tử cải dầu…
ứng dụng:
Ca
SO4.H2O sử dụng làm khuôn đúc
Phèn chua K2SO4.Al(SO4)3.24H2O làm trong nước
(NH4)2S2O8 được dùng làm tẩy trắng và khử trùng.
Kali thiosunfat (K2S2O3) giúp chữa bệnh xung quanh da.
Xem thêm: Video highlight việt nam vs malaysia 0, highlights việt nam 3
Hydrogen: cần sử dụng làm mỏ hàn – oxy hàn để giảm kim loại, bơm khinh thường khí cầu, làm cho nhiên liệu cho hộp động cơ tên lửa, bộ động cơ ô tô thay thế sửa chữa xăng…
flo:
Vai trò:
Là vi hóa học tham gia vào những quá trình cải cách và phát triển răng, hình thành ngà răng cùng men răng.
Đóng vai trò quan trọng đặc biệt trong quá trình tạo xương và ảnh hưởng đến quy trình điều hòa, đưa hóa canxi-photpho.
Thực phẩm: đựng được nhiều flo như lá chè, bắp cải, xà lách, rau câu, tôm, cua…
Ứng dụng:
Na
F: thêm F– vào nước nghèo yếu tắc vi lượng hoặc cung ứng kem tấn công răng để ngừa sâu răng..
F còn được đính thêm vào các hợp hóa học hữu cơ để tăng công dụng sinh học.
6. Bài xích tập vận dụng:
Câu 1: riêng biệt phi kim với kim loại:
Cả sắt kẽm kim loại và phi kim đều sở hữu sự biệt lập về cả đặc thù hóa học với vật lý.
Kim các loại là hóa học dẫn điện và nhiệt không hề nhỏ và khi bị thay đổi hóa học, bọn chúng sẽ rời ra những electron và trở thành cation. Kế bên ra, sắt kẽm kim loại là hóa học rắn ở ánh nắng mặt trời phòng và linh hoạt và có thể kéo dãn. Thông thường, chúng bao gồm một hoặc nhì màu đa phần là màu bội nghĩa trong trơn râm.
Mặt khác, phi kim loại chưa phải là chất dẫn điện bởi vậy và nhấn được những điện tử và trở thành anion khi chúng trải qua các biến đổi hóa học. Ngoài ra, phi kim loại hoàn toàn có thể ở thể rắn, lỏng hoặc khí và có tương đối nhiều màu sắc đẹp khác nhau. Chúng giòn và không co và giãn được hoặc ko linh hoạt nếu chúng ở dạng rắn.
Như vậy chúng ta cũng có thể rút ra điểm biệt lập cơ bản giữa kim loại và phi kim như sau:
– kim loại là hóa học dẫn điện cùng dẫn nhiệt độ tốt, phi kim dẫn nhiệt tương đối kém.
– kim loại dẻo và dễ uốn trong những khi phi kim thường xuyên rắn.
– kim loại thường sinh hoạt dạng rắn trong lúc phi kim đa dạng hơn hoàn toàn có thể ở thể rắn, lỏng hoặc khí.
– sắt kẽm kim loại có độ bóng hoặc sáng duy nhất định trong khi phi sắt kẽm kim loại bị xỉn màu; phi kim mặc dù nhiên, có không ít màu sắc đẹp khác nhau.
– sắt kẽm kim loại thường chế tạo ra thành oxit bazơ trong lúc phi kim là hóa học oxi hóa tốt.
– sắt kẽm kim loại khi bị công dụng hoá học tập thì đổi khác electron tránh còn phi kim thì thu được electron và trở thành anion.
– Điểm lạnh chảy với điểm sôi của phi kim thấp hơn đáng chú ý so với kim loại,
ngoại lệ là Carbon.
– Phi kim là cacbon, hydro, nitơ, phốt pho, oxy, giữ huỳnh, selen, halogen với khí quý.
Câu 2: Khử trọn vẹn 69,6 gam hỗn hợp A bao gồm Fe
O, Fe2O3, Fe3O4 và Cu
O ở ánh nắng mặt trời cao thành kim loại cần 24,64 lít khí teo (đktc) và thu được x gam hóa học rắn. Cũng mang đến 69,6 gam A công dụng với dung dịch HCl đầy đủ thu được hỗn hợp B chứa y gam muối. Cho B chức năng với dung dịch Na
OH dư thấy tạo ra thành z gam kết tủa.
a) Giá trị của x là
A. 52,0g. B. 34,4g.
C. 42,0g. D. 28,8g.
b) Giá trị của y là
A. 147,7g. B. 130,1g.
C. 112,5g. D. 208,2g.
c) Giá trị của z là
A. 70,7g. B. 89,4g.
C. 88,3g. D. 87,2.g
Hướng dẫn:
a) n
CO = 24,64/22,4 = 1,1 mol
Ta có: a
CO + M2Oa → 2M + a
CO2
Theo phương pháp tăng bớt khối lượng:
Cứ 1 mol co phản ứng → trọng lượng chất rắn giảm xuống 16 gam
→ Vậy gồm 1,1 mol teo phản ứng → cân nặng chất rắn giảm xuống 16.1,1 = 17,6 gam
Khối lượng chất rắn sau bội phản ứng là: x = 69,6 – 17,6 = 52 gam
→ Đáp án A
b) Theo ý a) ta tất cả hỗn hợp oxit bị khử hoàn toàn → n
O(oxit) = n
CO bội nghịch ứng = 1,1 mol
69,6 gam A + hỗn hợp HCl (vừa đủ) → dung dịch B chứa y gam muối
M2Oa + 2a
HCl → 2MCla + x
H2O
Theo cách thức tăng bớt khối lượng:
Ta phân biệt 1 mol O vào oxit bị sửa chữa bởi 2 mol Cl để tạo ra thành muối bột → khối lượng muối tăng so với cân nặng oxit là: 2.35,5 – 16 = 55 gam
→ 1,1 mol O vào oxit bị thay thế bởi 2,2 mol Cl → cân nặng muối tăng so với cân nặng oxit là: 1,1.55 = 60,5 gam
→ y = 69,6 + 60,5 = 130,1 gam
→ Đáp án B
c) Cho B + hỗn hợp Na
OH dư → z gam kết tủa
MCla + a
Na
OH → M(OH)a + a
Na
Cl
Theo cách thức tăng bớt khối lượng:
Ta nhận thấy 1 mol Cl trong muối bị thay thế sửa chữa bởi 1 mol OH để tạo ra thành hiđroxit → cân nặng hiđroxit sút so với trọng lượng muối là: 35,5 – 17 = 18,5 gam
→ 2,2 mol Cl trong muối bột bị sửa chữa bởi 2,2 mol OH → khối lượng hiđroxit sút so với khối lượng muối là: 18,5.2,2 = 40,7 gam
→ z = 130,1 – 40,7 = 89,4 gam
→ Đáp án B
Câu 3: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X cùng dd Y. Cho thấy khổi lượng dd Y tăng xuất xắc giảm bao nhiêu so cùng với dd Ca(OH)2 ban đầu?
Hướng dẫn:
n
Ca(OH)2 = 0,05.2=0,1 mol
T = n
CO2 : n
Ca(OH)2 = 0,16/0,1 = 1,6 → 1 3 và Ca(HCO3)2
CO2 + Ca(OH)2 → Ca
CO3 ↓ + H2O
0,1……….0,1…………0,1
→ Số mol CO2 dùng để hòa rã kết tủa là: 0,16 – 0,1 = 0,06 mol
CO2 + Ca
CO3 + H2O → Ca(HCO3)2
0,06 → 0,06
→ Số mol kết tủa sót lại là: 0,1 – 0,06 = 0,04 mol
→ m ↓ = m
Ca
CO3 = 0,04.100 = 4g
→ mdd tăng = m
CO2 – m
Ca
CO3 = 0,16.44 – 4 = 3,04g
Câu 4: Nung tất cả hổn hợp X gồm Fe
CO3 và Ba
CO3 trong bầu không khí đến trọng lượng không đổi, thu được chất rắn Y cùng V lít CO2 (đktc). Hòa hợp Y vào H2O dư thu được dung dịch Z và 8 gam chất rắn không tan. Dung nạp hết V lít khí CO2 vào Z thu được 9,85 gam kết tủa. Cân nặng của Fe
CO3 và Ba
CO3 trong hỗn hợp ban đầu?
Hướng dẫn:
4Fe
CO3 + O2 −to→ 2Fe2O3 + 4CO2
x………………→ 0,5x ……. X
Ba
CO3 −to→ Ba
O + CO2
y …………..→.. Y……y
n
CO2 = x+y
Chất rắn Y gồm: Fe2O3 và Ba
O
Y + H2O dư: hóa học rắn không tan là Fe2O3
→ 160.0,5x = 8 → x = 0,1 mol → n
CO2 = 0,1 + y
Ba
O + H2O → Ba(OH)2
y.…………..→……..y
Dung dịch Z là dung dịch Ba(OH)2
Ba(OH)2 + CO2 → Ba
CO3 + H2O
y……. →…… y…… y
→ Số mol CO2 dư nhằm hòa tan kết tủa Ba
CO3 là: (0,1+y) – y =0,1 mol
CO2 + Ba
CO3 + H2O → Ba(HCO3)2
0,1…→…..0,1…………………..0,1
n
Ba
CO3 = y-0,1 = 9,85/197 = 0,05 mol → y = 0,15 mol
m
Fe
CO3 = 0,1.116 = 11,6g
m
Ba
CO3 = 0,15.197 = 29,77g
Câu 5: Nung 10,23 gam hỗn hợp hai oxit là Cu
O với Pb
O cùng với cacbon dư.Toàn cỗ lượng khí CO2 sinh ra được dẫn vào bình đựng dung dịch
Ca(OH)2 dư. Phản ứng chấm dứt thu được 5,5 gam kết tủa. Tính thànhphần trăm theo trọng lượng của từng oxit kim loại trong láo hợp.